



2021-12-09
近期,非洲猪瘟I型毒株被报道,猪场对于该类毒株的演变和毒力不太了解,因此查阅相关文献后,对该类毒株做了一个较为详细的分析,其中不少猪场关心对该类毒株的鉴别诊断,在文章中介绍了几种方案,第一种是直接测序分型(文章中有引物序列),第二种是通过对MGF和eGFP基因组合的鉴定,对毒株的分型进行推论,下面为详细内容。
一、中国境内非洲猪瘟I型毒株的报道
1.1哈兽研对基因I型毒株的报道
中国农业科学院哈尔滨兽医研究所国家非洲猪瘟专业实验室首次报道,基因I型非洲猪瘟病毒已入侵我国田间猪群,并可引起慢性感染发病。相关研究论文“Genotype I African swine fever viruses emerged in domestic pigs in China and caused chronic infection”于2021年10月28日在线发表在《新发微生物与感染(Emerging Microbes & Infections)》杂志上。
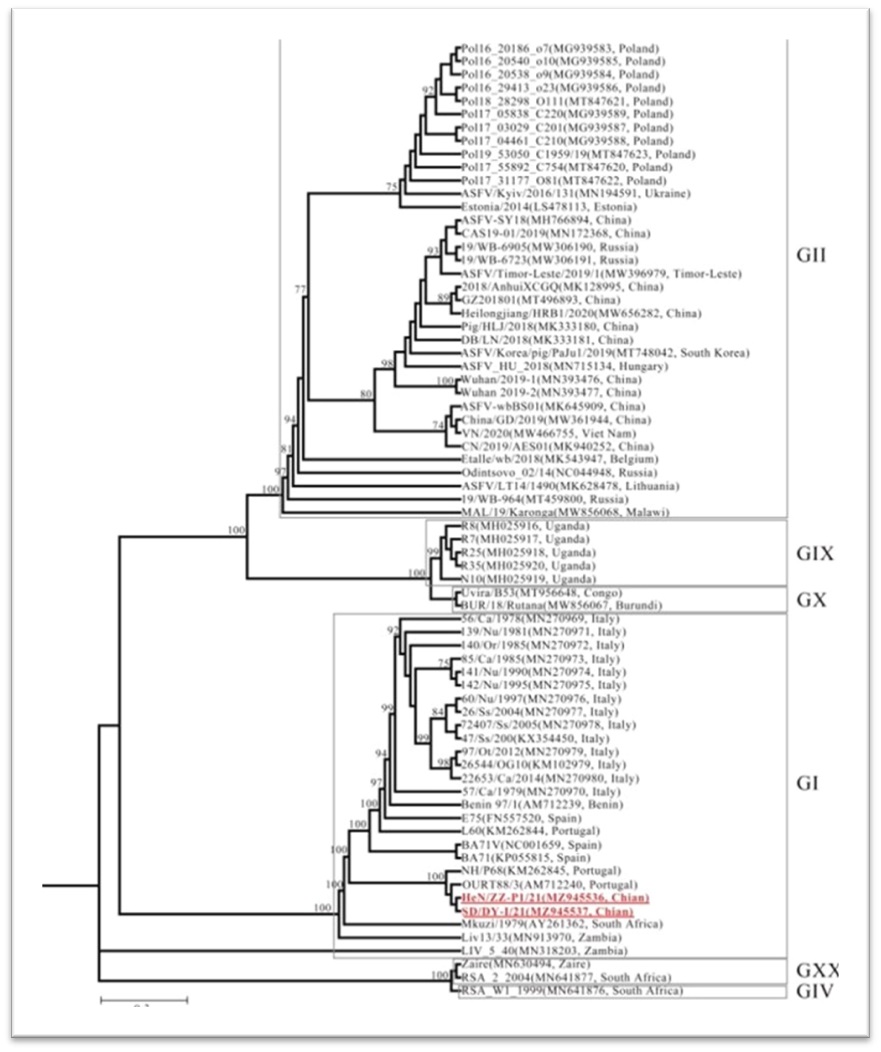
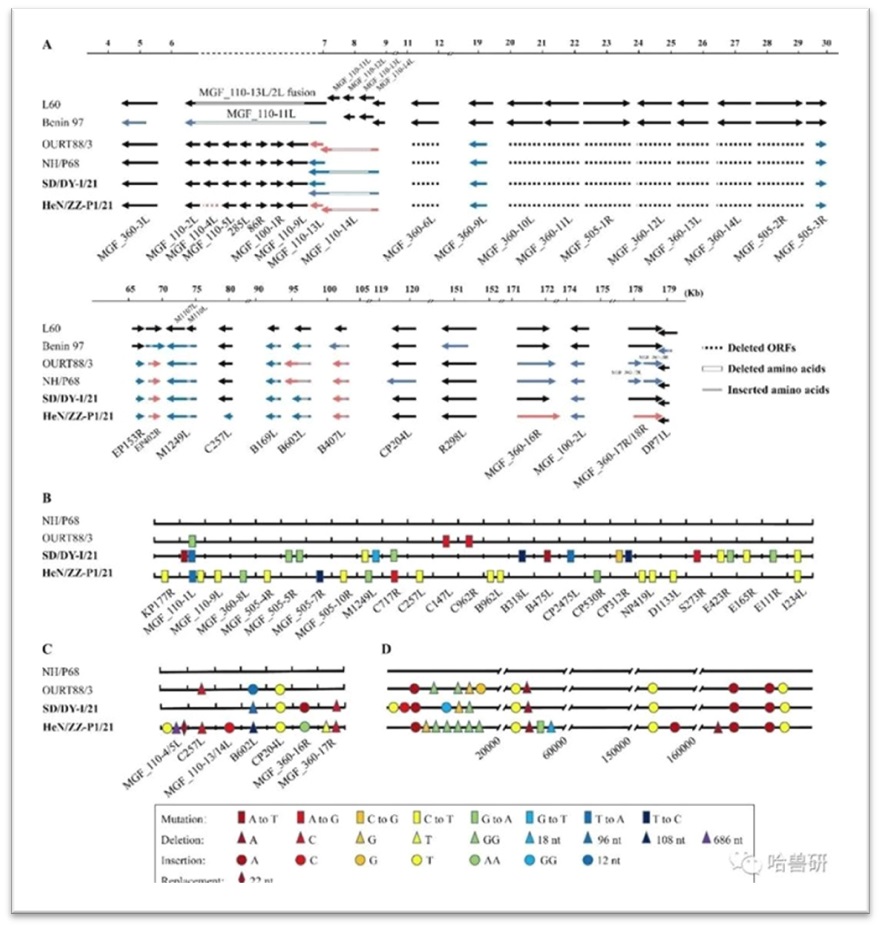
国家非洲猪瘟专业实验室科研人员在流行病学监测及病原学研究过程中,从山东和河南两地猪场临床发病猪样品分离出两株基因 I 型非洲猪瘟病毒SD/DY-I/21和HeN/ZZ-P1/21,两株病毒均无血吸附活性。全基因组进化分析表明,这两株病毒与上世纪葡萄牙分离的基因I型低致死毒株NH/P68和OURT88/3高度相似,与欧洲及非洲早期分离的基因I型强毒株L60和Benin 97存在较大差异(图1)。SD/DY-I/21和HeN/ZZ-P1/21尽管全基因组序列高度相似,但部分基因存在明显突变差异,提示二者有可能属于不同的入侵来源(图1)。NH/P68于1968年从葡萄牙的一头具有慢性症状的家猪中分离, OURT88/3于1988年从葡萄牙猪场的软蜱中分离[1]。
基因I型ASFV主要分为强毒力毒株(例如,L60和Benin97)和弱毒力毒株(例如,NH/P68和OURT88/3);我国的SD/DY-I/21和HeN/ZZ-P1/21的基因串行分别与NH/P68和OURT88/3高度相似。
图1:根据SD/DYI/21、HeN/ZZ-P1/21和GenBank数据库中70株参考菌株的全基因组序列构建的系统发育树(括号内为登录号)。Gi,所有菌株均为I型ASFVs。Gii,所有菌株都是II型ASFVs。红色黑体表示本研究中的分离株
1.2非洲猪瘟病毒的分型
由于ASFV没有明确的血清分型,在进行流行病学调查时多依赖与分离毒株的遗传进化分析,以实现基因分型和研究。现在常用有病毒遗传进化分析的基因包括p72、pB602L和p54基因。
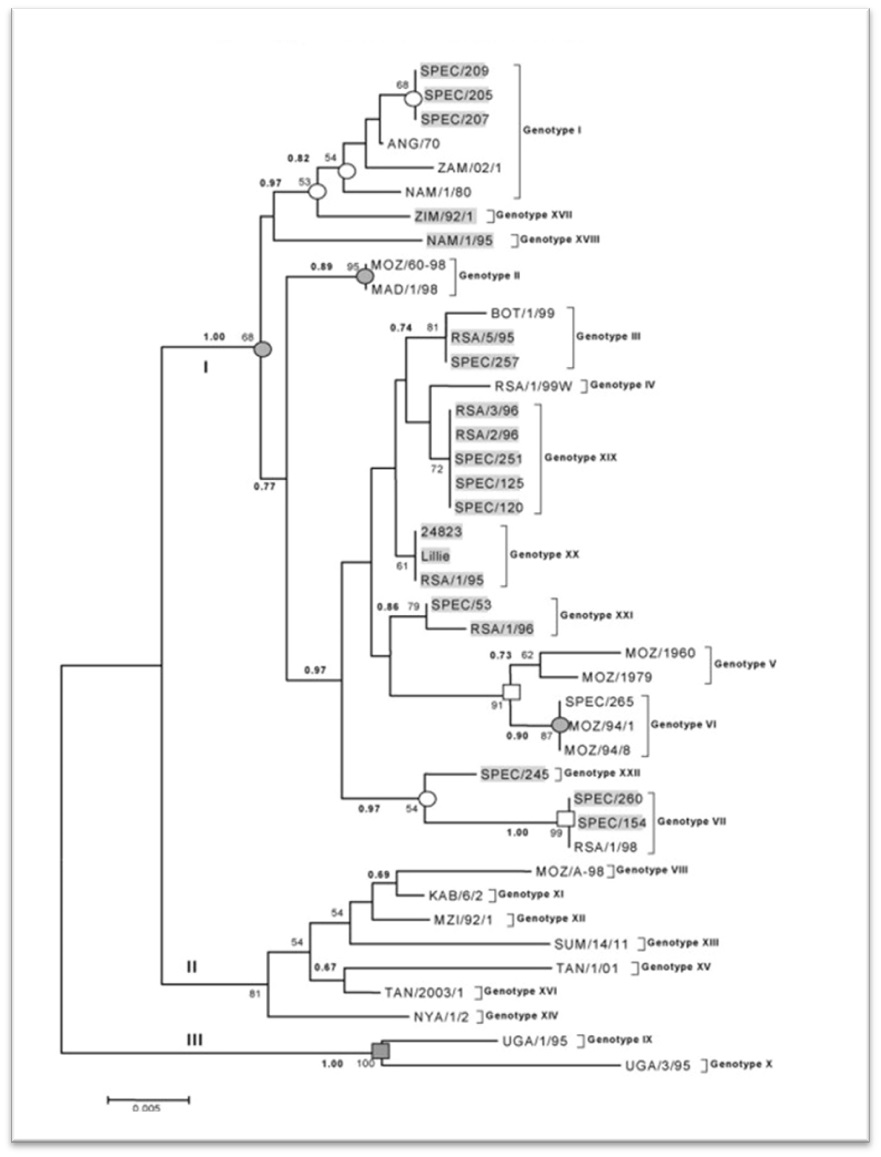
ASFV p72基因3’末端的478b核苷酸序列在不同毒株之间有明显的差异,常被用于遗传进化分析,据此可将ASFV分离株分为22个基因型。如下图2,是运用neighbor-joining进化树算法对1973-1999年非洲分离的42猪ASFV用P72基因进行遗传进化分析[2]。
图2:运用neighbor-joining进化树算法对1973-1999年非洲分离的42猪ASFV用P72基因进行遗传进化分析
1.3 非洲猪瘟毒株的分型引物
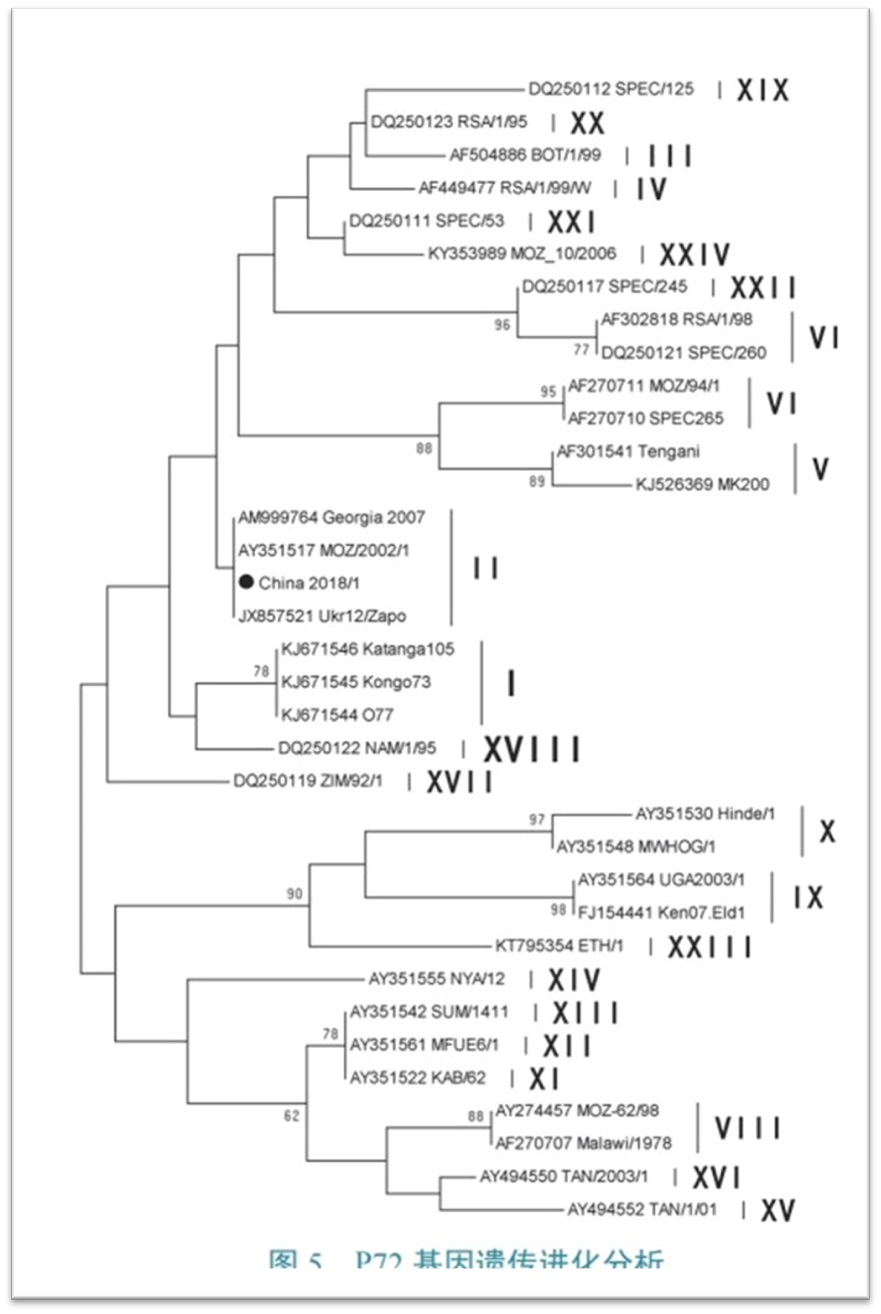
非洲猪瘟病毒扩增p72基因分型的通用型引物P72-U (5’-GGCACAAGTTCGGACATGT-3’) and P72-D (5’-GTACTGTAACGCAGCACAG-3’),我国首例非洲猪瘟病毒确诊时进行分型,使用该对引物[3]。
图3:我国首例非洲猪瘟毒株的P72基因遗传进化分析
二、SD/DY-I/21和HeN/ZZ-P1/21毒株的毒力
为了确定所分离到的基因I型毒株的致病性,研究者把山东株在活猪上进行了测试。每组6头SPF猪分别肌注10^3 TCID50 和10^6 TCID50剂量的病毒。在接种后的第3-18天,所有被攻毒的猪都不同程度表现出间歇性发热。在10^6剂量的攻毒组中,三头猪在第11天开始在颈部、耳后、腹部甚至全身的皮肤上出现丘疹。从第 13 天和第 17 天开始,所有六头猪都开始出现关节病;两只猪分别在接种后第 14 天和第 25 天开始跛行。两只猪分别在注射后第 17 天和第 20 天出现多发局灶性皮肤坏死。在 28 天的观察期内,所有的猪都存活了下来。
图4:基因I型分离株SD/DY-I/21引起慢性感染发病
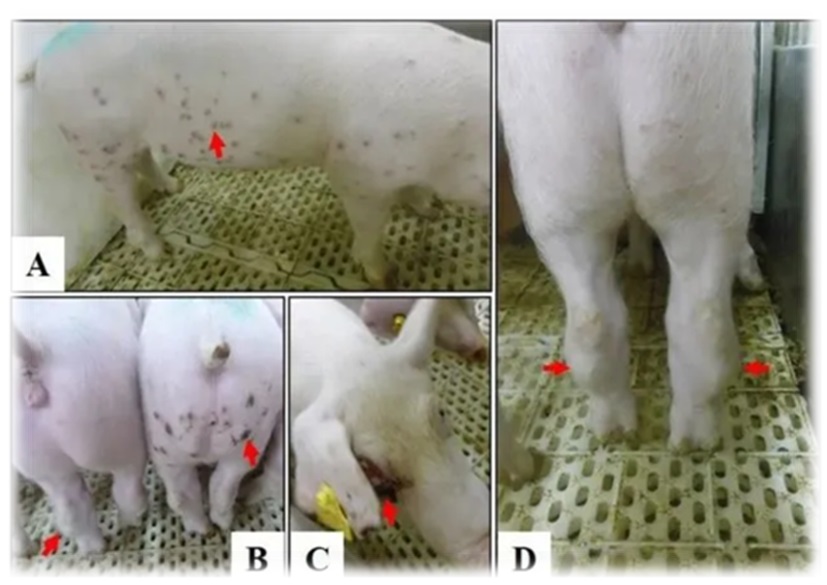
为了评估病毒脱落和病毒血症的情况,对实验猪进行了口腔拭子、直肠拭子和血液样本的采集,每隔一天使用 qPCR 检测ASFV基因组DNA。对于接种了 10^6 TCID50 山东株的猪,在第5天的口腔拭子、第7天的直肠拭子和第7天的血液中可检测到病毒 DNA。对于接种了 10^3 TCID50 病毒的猪,在接种后第 9 天的口腔拭子、接种后第 11 天的直肠拭子和接种后第 7 天的血液中可检测到病毒 DNA。在所有接种猪感染后超过 28 天,在口腔和直肠拭子中检测到病毒 DNA。一般来说,与直肠拭子相比,口腔拭子中的病毒脱落更早且水平更高。
三、临床毒株分型方案
3.1使分型引物对P72基因扩增后分析。
p72基因分型的通用型引物P72-U (5’-GGCACAAGTTCGGACATGT-3’) and P72-D (5’-GTACTGTAACGCAGCACAG-3’)。
3.2 MGF天然缺失可作为检测依据。
NH/P68于1968年从葡萄牙的一头具有慢性症状的家猪中分离, OURT88/3于1988年从葡萄牙猪场的软蜱中分离,NH/P68与OURT88/3自然缺失了大量基因,其中哈兽研双缺失疫苗中缺失的一个基因MGF360-505R在NH/P68与OURT88/3毒株中也是缺失的,因此猪场可对检测出的阳性样本,进行MGF360-505R检测,如存在MGF360-505R可判定为II型,如缺失了MGF360-505R则可能为II型假疫苗或I型毒株。
图5:SD/DY-I/21和HeN/ZZ-P1/21全基因组与欧洲及非洲早期基因I型分离株的比较分析
3.3对荧光基因进行鉴别
哈兽研与军事兽医研究所所披露的非瘟疫苗中均使用了荧光基因,哈兽研使用荧光基因为mCherry和eGFP,军事兽医研究所使用的荧光基因为RFP和eGFP,因此猪场可对检测出来的阳性样本,再次测试eGFP基因,当为阳性时,可以判断为II疫苗毒株。
图6:哈兽研双缺失疫苗
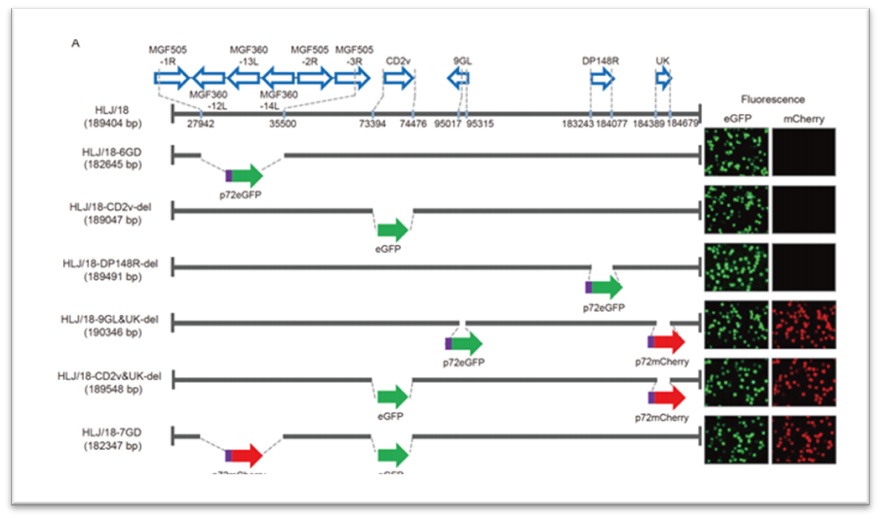
图7:ASFV基因缺失病毒构建策略图
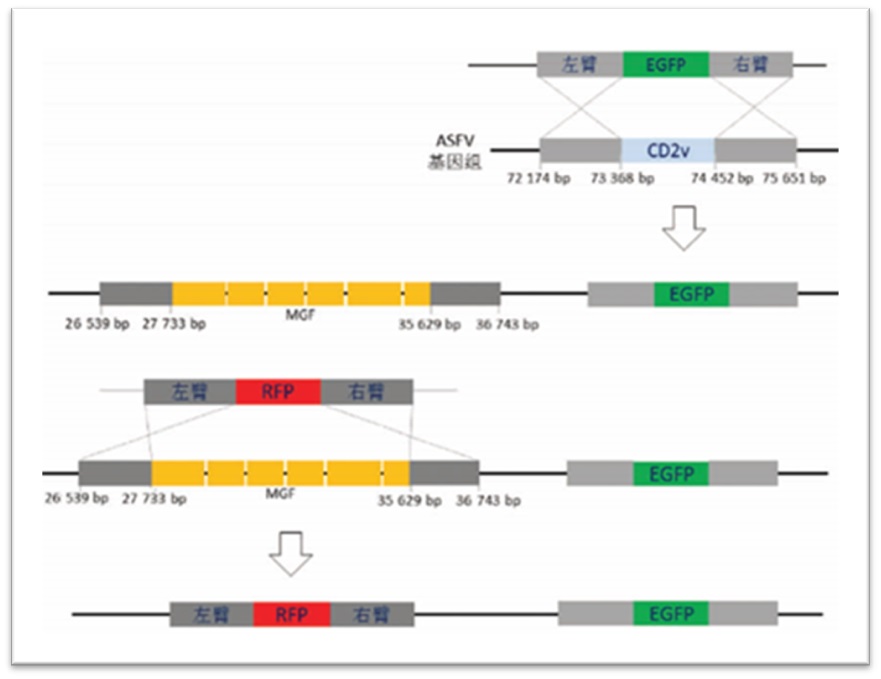
表1:不同非洲猪瘟毒株中p72、MGF、eGFP基因
| 毒株 | p72 | MGF | eGFP |
| HLJ/2018 | √ | √ | × |
| NH/P68 | √ | × | × |
| 双缺失疫苗 | √ | × | √ |
| 变异毒株 | √ | √ | × |
注:√为含有,×为不含有。
四、对临床的影响
4.1 非瘟I型毒株与上半年发现的II型变异毒株,在临床上较为类似,且该毒株流行已久,猪场不必过于惊慌。
4.2毒株重组。
今后可能会出现不同基因型毒株的重组,防控难度可能会增加。
4.3对疫苗研发的影响。
相关机构研发非洲猪瘟疫苗时,需要考虑对I型毒株的保护力了,疫苗研发难度增加。
参考文献:
[1]Sun Encheng,Huang Lianyu,Zhang Xianfeng,Zhang Jiwen,Shen Dongdong,Zhang Zhenjiang,Wang Zilong,Huo Hong,Wang Wenqing,Huangfu Haoyue,Wang Wan,Li Fang,Liu Renqiang,Sun Jianhong,Tian Zhijun,Xia Wei,Guan Yuntao,He Xijun,Zhu Yuanmao,Zhao Dongming,Bu Zhigao. Genotype I African swine fever viruses emerged in domestic pigs in China and caused chronic infection.[J]. Emerging microbes & infections,2021:
[2] Boshoff C I , Bastos A , Gerber L J , et al. Genetic characterisation of African swine fever viruses from outbreaks in southern Africa (1973-1999).[J]. Veterinary Microbiology, 2007, 121(1-2):45-55.
[3]王清华, 任炜杰, 包静月,等. 我国首例非洲猪瘟的确诊[J]. 中国动物检疫, 2018, 35(9):4.